| 2-phényléthanol [35259] |
|
| Posté le : 17/01/2007, 14:58 (Lu 65184 fois) |
Commentaire : synthése ?
Salut !
j'aimerais savoir si il existe un moyen de synthétiser du 2-phényléthanol à partir d'une substance déjà plus courante que le 2-phényléthanol 
2-phényléthanol :
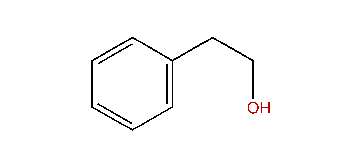
D'avance merci !
----------
Edité le 17/01/2007 à 14:58 par Maxg59
| |
|
|
| Re: 2-phényléthanol |
|
| Posté le : 17/01/2007, 16:31 (Lu 65175 fois) |
à partir de quoi tu veux le synthétiser ? benzène, toluène ou éthylbenzène?
| |
|
|
| Re: 2-phényléthanol [35274] |
|
| Posté le : 17/01/2007, 16:32 (Lu 65173 fois) |
benzéne OK, toluéne, bouéf, ethyl benzéne sa je devrai aussi pouvoir en avoir .....
| |
|
|
| Re: 2-phényléthanol [35278] |
|
| Posté le : 17/01/2007, 16:38 (Lu 65169 fois) |
je vais réfléchir tranquilement et je vais essayer de te proposer plusieurs synthèses
| |
|
|
| Re: 2-phényléthanol [35279] |
|
| Posté le : 17/01/2007, 16:39 (Lu 65167 fois) |
merci bôôôôôcoup !
| |
|
|
| Re: 2-phényléthanol [35280] |
|
| Posté le : 17/01/2007, 16:39 (Lu 65166 fois) |
tu as du matériel ou c'est "artisanal" ???
| |
|
|
| Re: 2-phényléthanol [35283] |
|
| Posté le : 17/01/2007, 16:44 (Lu 65164 fois) |
j'ai du matériel, enfin sa dépend de se que tu apel matériel ....
pour faire quoi exactement ?
(je ne peu rester que sous pression atmosphérique ....)
| |
|
|
| Re: 2-phényléthanol [35286] |
|
| Posté le : 17/01/2007, 16:53 (Lu 65161 fois) |
tu peux à partir du benzène faire une alkylation de Friedel-Craft avec du 1-chloroéthan-2-ol et AlCl3 (ou FeCl3 ça marche aussi). le problème est que par cette méthode tu peux avoir des problèmes de polyaddition.
le remède c'est l'acylation de Friedel-Craft avec l'acyle d'éthanol (je suis vraiment pas sur du nom... mais je pense qu'on se comprend) et aussi AlCl3 puis faire une réduction de la cétone avec une réaction de Clemmensen (Zn, HCl, chauffage). je pense que ça doit marcher.
par contre à partir du toluène ou de l'éthylbenzène, ça doit etre un peu plus compliqué...
voilà !!!
| |
|
|
| Re: 2-phényléthanol [35288] |
|
| Posté le : 17/01/2007, 16:56 (Lu 65155 fois) |
ne me manque plus qu'a synthétiser de "l'acyl d'éthanol"  lol lol
merci bien chemist38 !
si quelqu'un aurai une méthode un peu plus simple sa serai bien, sinon je sais pas si je vais le faire, sa me prendrai beaucoup de temps, en comptant qu'il faut seulement que je synthétise le benzéne ^^
----------
Edité le 17/01/2007 à 16:57 par Maxg59
| |
|
|
| Re: 2-phényléthanol [35292] |
|
| Posté le : 17/01/2007, 17:12 (Lu 65151 fois) |
La première réaction devrait coller, mais pour éviter tout problème (l'alcool libre me plait pas trop), il faudrait protéger l'alcool...
Pour ta deuxième réaction, il s'agirait de l'hydroxy-acetyl chloride, mais ce composé n'est pas commercial....
Faudrait trouver quelque chose de pls élégant... Dès que j'ai u instant à moi, je me pencherais sur le problème.
Milamber.
| |
|
|
| Re: 2-phényléthanol [35563] |
|
| Posté le : 18/01/2007, 23:36 (Lu 65030 fois) |
Citation : chemist38
tu peux à partir du benzène faire une alkylation de Friedel-Craft avec du 1-chloroéthan-2-ol et AlCl3 (ou FeCl3 ça marche aussi). le problème est que par cette méthode tu peux avoir des problèmes de polyaddition.
|
|
Bonsoir,
En remplaçant le 1-chloro 2-éthanol (trés toxique) par du 1-2-DichloroEthane tu peux obtenir un mélange de 1-2 diphénylEthane et de Chlorure de PhénylEthanol. Ces deux produits ont des volatilités et T° d e fusions trés différentes: donc leur séparation ne doit pas être si difficile. Pour orienter la réaction dans le bon sens il faut jouer sur les proportions relatives. Le phénomène des polyadditions, voire pour cette réaction de polymérisations est bien réel. Pour les éviter il existe des méthodes assez complexes, précieuses quand les réactifs de départ sont rares. Ici les produits employés ne sont pas trop chers..
Le Chlorure de phényléthanol peut s'hydrolyser en présence de soude alcoolique pour former l'alcool phényléthylique.
Attention les molécules comportant une chaine Cl-CH 2-CH 2- O, S ou N sont TRES TOXIQUES (vésicants)
|
Tri+traitement Produits chimiques 77 (Seine et Marne) |
|
|
| Re: 2-phényléthanol [38733] |
|
| Posté le : 28/02/2007, 15:37 (Lu 64875 fois) |
Synthèse à partir du benzène.
Bonjour,
j'ai été intéressé par le projet de synthèse du phenyl-2 ethanol.
Ayant travaillé sur le sujet il y a longtemps, je serais heureux d'apporter quelques nouveaux éléments de réponse.
Les réactions utilisées sont faciles à mettre en oeuvre , les réactifs simples et les rendements bons :
1. Chlorométhylation :
C6H6+ HCOH + HCl donnent C6H5CH2Cl
2.Grignard pour obtenir l'acide carboxylique correspondant :
C6H5CH2MgCl
+ CO2 donnent l' acide phenyl-2 ethanoique. Ce produit à une odeur d' urine caractéristique.
3.Estérification de Fisher pour obtenir l'ester ethylique correspondant :
C6H5CH2COOH
+ CH3CH2OH +
H2SO4 donnent
l'ester. Ce produit à une odeur de jacinthe.
4.Réduction de Bouveault et Blanc :
l' ester précédent , mis en solution dans l'éthanol absolu , est réduit par le Sodium métallique. Ce produit le Phenyl-2 ethanol à une odeur de rose. Il est utilisé en parfumerie , tout comme l'ester
précédent. C'est lui qui donne son odeur à l'eau de rose.
Celle-ci , avec le temps , à une odeur qui vire et devient désagéable
(elle migre vers une odeur d' urine ) C'est l'inverse de ce que nous venons de faire . C'est l'oxydation du Phenyl-2 ethanol en acide Phenyl-2 ethanoique par l'oxygène de l'air qui provoque cette
dégradation.
| |
|
|
| Re: 2-phényléthanol [38755] |
|
| Posté le : 28/02/2007, 18:22 (Lu 64862 fois) |
Je ne vois pas exactement ou trouver le 2-phényléthanol dans tes réponses ... en revanche j'ai trouvé un mod opératoire de synthèse du 2-phényléthanol à la bibliothèque municipale ... si tu veux je peux aller le chercher ...
| |
|
|
| Re: 2-phényléthanol [38760] |
|
| Posté le : 28/02/2007, 20:35 (Lu 64854 fois) |
Le 2-phényléthanol est obtenue à la fin par réduction de l'ester par le sodium.
Protocole intéressant... Le seul point noir est le benzène...
Peut-être à remplacer par une chloration radicalaire du toluène par le chlore... Mais on ne fait que déplacer le problème de la toxicité... lol
En tout cas merci pour cette synthèse.
Milamber.
| |
|
|
| Re: 2-phényléthanol [38769] |
|
| Posté le : 01/03/2007, 06:53 (Lu 64835 fois) |
Bonjour,
Le Phenyl-2 ethanol est obtenu par la réduction de Bouveault et Blanc
sur le Phenyl-2 ethanoate d' Ethyle au cours de l' étape 4.
Cette technique de réduction a l'avantage de ne pas employer de réactifs couteux ( Li Al H 4 OU DiBorane ) et de ne pas necessiter de conditions absolument anhydres pour fonctionner, la solution dans l'alcool absolu suffit.
Tu as une bonne bibliothèque municipale! Le mode opératoire que tu as trouvé m'intéresse, pourrais-tu l'envoyer?
Avec mes remerciements.
| |
|
|
| Re: 2-phényléthanol [38763] |
|
| Posté le : 28/02/2007, 22:37 (Lu 64846 fois) |
merci bien de votre aide et de cette réponse ! 
| |
|
|
| Re: 2-phényléthanol [35296] |
|
| Posté le : 17/01/2007, 17:27 (Lu 65148 fois) |
tu veux synthétiser du benzène ??? je crois que j'ai pas compris là.
normalement l'alkylation doit marcher. pour protéger l'alcool comme le dit milamber, il te faut NaH et du chlorure de benzyle. on obtient alors une molécule R-O-Bn (où Bn est le groupement benzyle). pour déprotéger, il faut H2 avec Pd/C.
| |
|
|
| Re: 2-phényléthanol [35308] |
|
| Posté le : 17/01/2007, 18:30 (Lu 65140 fois) |
oui, je n'ai pas mon litre de benzéne à portée, je le synthétise moi même (se qui finalement me revien cher ! mdr)
j'ai accés a tout les produits, mais bon, si je cherche à synthétiser le 2-phényléthanol, c'est que je ne sougaite pas en acheter, et donc pas d'autres produits non plus, NaH ... bouéf ...
Merci milamber d'essayer de trouver uns solution un peu plus facile ......
| |
|
|
| Re: 2-phényléthanol [35310] |
|
| Posté le : 17/01/2007, 18:42 (Lu 65137 fois) |
Juste pour savoir, tu le destines à quoi ton 2-phénétyléthanol ?
Milamber.
| |
|
|
| Re: 2-phényléthanol [35311] |
|
| Posté le : 17/01/2007, 18:43 (Lu 65135 fois) |
l'odeur de rose of course ^^
il m'en fodrai une petite centaine de mL 
| |
|
|
| Re: 2-phényléthanol [35325] |
|
| Posté le : 17/01/2007, 19:04 (Lu 65131 fois) |
en regardant la télé tout à l'heure j'ai trouvé comment synthétiser ton produit à partir du toluène : par réaction avec un magnésien. j'explique ma pensée :
1) on fait la protection de l'alcool comme on a expliqué plus haut
2) on fait une réaction de Grignard avec l'alcool protégé
à coté :
1) oxydation du toluène en acide benzylique avec KMnO4, H2O, OH-
2) soit estérification avec de l'éthanol et catalyse acide puis réaction avec 2 équivalents du magnésien et hydrolyse acide
soit réduction de l'acide avec B2H6 puis H2O2/NaOH pour avoir le benzaldéhyde que l'on fait réagir avec un équivalent de magnésien suivi évidemment d'une hydrolyse acide
3) il faut éliminer l'alcool formé par réaction avec le magnésienvet pour cela, je vois 2 possibilités :
- réaction de Barton-Mc Combie
- réaction avec un sulfonate : on fait réagir notre alcool avec du chlorure de tosyle dans la triéthylamine puis on rajoute LiBHEt3 qui fait une réaction type SN2.
normalement après tout ça, on obtient notre produit mais le rendement est à déterminer...
| |
|
|
| Re: 2-phényléthanol [35335] |
|
| Posté le : 17/01/2007, 19:28 (Lu 65123 fois) |
c'est un peu plus compliqué quand même !!!
| |
|
|
| Re: 2-phényléthanol [35340] |
|
| Posté le : 17/01/2007, 19:45 (Lu 65117 fois) |
Evite la réaction de Barton, ca fonctionne super mal et faut un donneur d'hydrure radicalaire bien toxique!
| |
|
|
| Re: 2-phényléthanol [35342] |
|
| Posté le : 17/01/2007, 19:54 (Lu 65111 fois) |
un donneur d'hydrure ???
| |
|
|
| Re: 2-phényléthanol [35346] |
|
| Posté le : 17/01/2007, 20:21 (Lu 65068 fois) |
Bhen oui Bu3SnH... enfin c'est un hydrure radicalaire.
| |
|
|
| Re: 2-phényléthanol [35347] |
|
| Posté le : 17/01/2007, 20:33 (Lu 63810 fois) |
un hydrure c'est H- alors que Bu3SnH donne un radical H (un atome d'hydrogène en fait).
| |
|
|
| Re: 2-phényléthanol [35349] |
|
| Posté le : 17/01/2007, 20:34 (Lu 63804 fois) |
et aussi avec H- c'est un doublet d'électrons qui est mis en jeu dans la réaction alors qu'avec Bu3SnH qui donne un radical, un seul électron est mis en jeu.
| |
|
|
| Re: 2-phényléthanol [35356] |
|
| Posté le : 17/01/2007, 20:49 (Lu 63791 fois) |
Maxg59 faut que tu m'expliques comment tu fais pour synthtiser le benzène. ça doit vraiment etre difficile comme réaction !
| |
|
|
| Re: 2-phényléthanol [35358] |
|
| Posté le : 17/01/2007, 20:55 (Lu 63785 fois) |
Mais dans la réduction de barton, on utilise bien un radical H. et pas un hydrure H-.
Sinon, ce que tu propose est faisable, mais pas tellement réaliste...
Le plus simple resterait un hydroboration du styrène par BH3, suivie de l'hydrolyse par H2O2/OH-.
Mais pas faisable par Max... Je vais regarder quelque chose de plus simple...
Milamber.
| |
|
|
| Re: 2-phényléthanol [35360] |
|
| Posté le : 17/01/2007, 20:58 (Lu 63769 fois) |
je n'y avait pas pensé !!! bien vu !
  
| |
|
|
| Re: 2-phényléthanol [35497] |
|
| Posté le : 18/01/2007, 20:37 (Lu 63605 fois) |
Bon alors après quelques cogitations et recherches, je te propose cette séquence :

Ca n'est pas la méthode la plus rapide, mais c'est relativement accessible à un chimiste amateur.
Le plus simple reste de l'acheter tout près ou alors par hydroboration du styrène...
Si tu veux plus d'infos (explications des réactions ou mod op, hésites pas).
Milamber.
| |
|
|
| Re: 2-phényléthanol [35501] |
|
| Posté le : 18/01/2007, 20:47 (Lu 63610 fois) |
ouuuuuaaarrrrrrrrrrrrrrrrrrrrrrf
Cl2 ok , Na OK ...
Mais KCN .......
pouarf !
La question n'est pa d'en acheter, mais d'en posséder ....
par curiositée, que devient le CN- aprés ?
| |
|
|
| Re: 2-phényléthanol [35514] |
|
| Posté le : 18/01/2007, 21:10 (Lu 63607 fois) |
C'est sur que KCN c'est pas génial comme réactif... mais bon, tant qu'on est pas en milieu acide, c'est pas trop horrible.
Sinon, en fait, ton nitrile est hydrolysé en acide par H2SO4 en présence d'eau, et avec l'éthanol dans le milieu, on estérifie dans la foulée... Et on élimine NH4+
Milamber.
| |
|
|
| Re: 2-phényléthanol [35517] |
|
| Posté le : 18/01/2007, 21:19 (Lu 63603 fois) |
OK !
je suis fier de moi car j'avais quand meme penser à l'esterification !
mais je ne pensais pas que ce serai aussi compliqué (enfin plutot dangereux ....)
je vais laisser tomber et en acheter ! merci infiniment milamber !
| |
|
|
Aztek Forum V4.00 Copyright (C) 2003 |