| Criastallisation du Sulfate de cuivre [54168] |
|
| Posté le : 17/02/2008, 15:55 (Lu 53631 fois) |
Bonjour a tout le monde
Je m'intéresse pour l'oral des TPE a la cristallisation du sulfate de cuivre non savons qu'il cristallise dans le système triclinique...j'ai trouvé une image de l'organisation des atomes du cristal mais je n'arrive pas a identifier certaines liaisons et d'autres choses me semblent assez bizarres. J'aimerais donc avoir vos élcaircicements au sujet des liaisons présentes dans ce cristal (covalentes, ioniques ou autres...)
voila l'image :
http://fr.wikipedia.org/wiki/Image:Copper%28II%29-sulfate-unit-cell-3D-balls.png
De plus la chalcantite (nom minéralogique) est un sulfate de cuivre pentahydraté [CuSO4 + 5 H2O] ou sont donc les 5H2O ?
Etant donné que le sulfate penthahydratée a été mis dans l'eau pour la cristallisation pourquoi ne serait-il pas "plus hydraté" ex: 10H2O... ?
----------
Edité le 17/02/2008, 15:59 par sil20
| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54180] | |
| Re: Criastallisation du Sulfate de cuivre [54192] |
|
| Posté le : 17/02/2008, 23:43 (Lu 53609 fois) |
Ok le lien n'était pas bon mais j'ai trouvé sa : http://scienceamusante.net/wiki/index.php?title=Sulfate_de_cuivre_pentahydrat%C3%A9
Ensuite je me pose une question : lorsque l'on dissou des cristaux de sulfate de cuivre pentahydratés obtient t-on par recristalisation des cristaux de sulfate de cuivre pentahydratés eux aussi ?
Si oui pourquoi cela ne pourrais pas former CuSO4, 7H2O ?
| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54197] |
|
| Posté le : 18/02/2008, 07:28 (Lu 53605 fois) |
Parce que c'est comme ça!
Le CuSO4 peut se lier au maximum à 5 molécules d'eau. Mais par thermogravimètrie on peut déterminer des forme mono et tri hydratées (à confirmer).
|
Associé de recherche en chimie médicinale (Bac+5) |
|
|
| Re: Criastallisation du Sulfate de cuivre [54232] |
|
| Posté le : 18/02/2008, 16:42 (Lu 53591 fois) |
Pourquoi est-ce que dans une représentation le soufre et lié avec 2 oxygènes et dans l'autre avec 4 Oxygènes (même s'il n'en parais que 3) ?
| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54234] |
|
| Posté le : 18/02/2008, 16:50 (Lu 53588 fois) |
En fait, le soufre est sur le bord de la maille, donc tu vois que la moitié de SO4
Citation
La même maille, centrée sur le cation Cu2+ (grosse boule bleue), entouré par 4 molécules d'eau, la 5e molécule d'eau est plus loin. Le soufre est en jaune et il semble connecté à 3 oxygènes uniquement, or il ne faut pas oublier que dans ces images, la maille doit être répétée dans les 3 directions de l'espace ! |
|
----------
Edité le 18/02/2008, 16:52 par Unkky
| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54247] |
|
| Posté le : 18/02/2008, 19:46 (Lu 53569 fois) |
En effet, en cristallographie, lorsqu'on dessine des cellules élémentaires (comme c'est le cas dans la page du wiki), il faut garder en tête que la cellule se répète à l'infini dans les trois directions de l'espace.
Comme dit Unkky, il faut imaginer les cellules voisines. Un atome sur une face de la cellule appartient à deux cellules voisines. Un atome sur une arête appartient à 4 cellules voisines. Un atome sur un coin appartient à 8 cellules voisines.
| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54237] |
|
| Posté le : 18/02/2008, 17:05 (Lu 53583 fois) |
Ah ok sa se précise merci de ton aide, la cristallographie c'est super intéressant mais niveau 1ereS il y a pas mal de truc assez compliqué a comprendre ne croyez pas que je mette de la mauvaise volonté bien au contraire...cependant je n'arrive pas a trouver quelles liaison rentre en jeu pour ordonner les atomes dans cet ordre.
Apparemment le soufre forme des doubles liaisons avec les atomes d'oxygène.
Cu : 29 électrons donc : K2 L6 M6 N6 O6 P3 il aurait donc tendance a perdre 3 électrons et pourtant c'est Cu2+
S : 16 électrons donc : K2 L6 M6 N2 il aurait donc tendance a former S2+
...Je n'y comprend plus rien

| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54246] |
|
| Posté le : 18/02/2008, 19:43 (Lu 53570 fois) |
Non déjà tu te trompes dans les configurations électroniques. On peut mettre 8 électrons sur les couches L et M. Et on peut en mettre 18 sur la couche N. Donc, en corrigeant ?....
Si tu écris la structure de Lewis de l'ion sulfate, en effet il y a des doubles liaisons entre S et chaque O. L'ensemble est chargé 2-.
| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54252] |
|
| Posté le : 18/02/2008, 20:28 (Lu 53564 fois) |
Cu : 29 électrons donc : K2 L8 M8 N11
S : 16 électrons donc : K2 L8 M6
Je vais cherché les représentations de Lewis pour mieux comprendre tout sa encore merci de votre aide je vous recontacterais si je n'y arrive pas ;)
| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54286] |
|
| Posté le : 19/02/2008, 15:24 (Lu 53545 fois) |
http://fr.wikipedia.org/wiki/Image:Sulfate-ion-2D-dimensions.png
on a :
S : K2 L8 M6
O : K2 L6
donc 2 doubles liaisons qui forme 2 Oxygènes avec leur couche externe saturée, le souffre perd donc 4 électrons.
Et 2 autres oxygènes qui gagne 1 électrons chacun du souffre on se retrouve donc avec 2 Oxygènes mais leur couche forme pourtant K2 L7 , la dernière n'est donc pas saturée et la je bute...
Mais on a bien le souffre qui pers 6 électrons en tout et qui se retrouve avec la couche L saturée 
bizarre bizarre
Puis pour l'ion Cu2+ je comprends pas d'ou il vient ni pourquoi il se met avec l'ion sulfate 
----------
Edité le 19/02/2008, 15:40 par sil20
| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54684] |
|
| Posté le : 24/02/2008, 16:29 (Lu 53507 fois) |
Je vous recontacte car je trouve vraiment pas quelles sont les liaisons qui mettent les atomes dans ces positions... 
| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54810] |
|
| Posté le : 27/02/2008, 15:48 (Lu 53410 fois) |
----------
Edité le 27/02/2008, 16:48 par khumeiabaf
| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54708] |
|
| Posté le : 25/02/2008, 11:10 (Lu 53495 fois) |
Personne n'arrive à comprendre pourquoi le cuivre perd deux électrons et devient alors stable en présence d'eau. C'est un fait qu'il faut prendre comme tel. Normalement le cuivre perd un électron et un seul, tant qu'il n'y a pas d'eau. Mais en présence d'eau, c'est un mystère : il perd deux électrons et devient Cu2+.
Dans le premier schéma publié sur Wikipedia, toutes les liaisons ne sont pas semblables. Elles représentent parfois des "plus courtes distances". Dans le prisme déformé qui y est représenté, les atomes S sont en jaune. Les Cuivre sont en brun. Les oxygène sont en rouge. Les Hydrogènes manquent. Les atomes S sont entourés de 4 liaisons S-O covalentes. Les atomes Cu sont des ions qui sont liés à 4 atomes O appartenant à des groupes SO4 proches (dans un plan), et à 2 atomes O un peu plus éloignés (sur un axe perpendiculaire au plan des 4 premiers O). Ces deux derniers O appartiennent à des molécules d'eau non dessinées. Il existe une liaison électrostatique entre ce ion Cu et ces 4 (voire 6) atomes O qui sont tous chargés négativement, avec parfois une charge partielle.
J'admets que ce n'est pas très facile à visualiser. Tu es tombé sur un cas particulièrement difficile à traiter, hélas !
|
Professeur de chimie de niveau préuniversitaire
|
|
|
| Re: Criastallisation du Sulfate de cuivre [54713] |
|
| Posté le : 25/02/2008, 16:50 (Lu 53477 fois) |
http://fr.wikipedia.org/wiki/Image:Sulfate-ion-2D-dimensions.png
Citation : maurice
Les atomes S sont entourés de 4 liaisons S-O covalentes |
|
Pourquoi on se retrouve avec deux Oxygène chargé négativement alors  ? ?
2 doubles liaisons qui donne 2 Oxygènes avec leur couche externe saturée, le Souffre perd donc 4 électrons.
Et 2 autres oxygènes qui gagne 1 électrons chacun du souffre on se retrouve donc avec 2 Oxygènes mais leur couche forme pourtant K2 L7 , la dernière n'est donc pas saturée et la je bute...
Mais on a bien le souffre qui pers 6 électrons en tout et qui se retrouve avec la couche L saturée
----------
Edité le 25/02/2008, 17:01 par sil20
| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54728] |
|
| Posté le : 25/02/2008, 22:43 (Lu 53449 fois) |
Je ne comprends pas ce que tu essaies de me dire avec tes "2 doubles liaisons qui donnent 2 Oxygènes".
Quoi qu'il en soit, le ion SO42- est formé d'un atome central de soufre que tu peux imaginer chargé ou non (cela ne joue aucun rôle ici). Cet atome S est lié à 4 atomes d'oxygène de manière parfaitement identique. On n'arrive pas à différencier ces atomes O. Ils sont liés par des liaisons simples ou doubles, peu importe. L'important, c'est que ces atomes O sont aux sommets d'un tétraèdre dont S occupe le centre, exactement comme les H de CH4 sont aux sommets d'un tétraèdre dont C occupe le centre.
Cependant il y a deux charges négatives sur deux atomes d'oxygène. Mais elles n'ont aucune raison d'être toujours sur les deux même atomes O. On doit même considérer que ces charges passent sans cesse d'un atome O à l'autre, de sorte que tout se passe comme si elles étaient distribuées en moyenne sur les 4 atomes O. Les 4 atomes O peuvent donc les quatre attirer un ion cuivre.
|
Professeur de chimie de niveau préuniversitaire
|
|
|
| Re: Criastallisation du Sulfate de cuivre [54813] |
|
| Posté le : 27/02/2008, 16:38 (Lu 53404 fois) |
Citation : wiki
le cation Cu2+ (grosse boule bleue) est entouré par 4 molécules d'eau, la 5e molécule d'eau est plus loin. |
|
Pourquoi l'ion Cu2+ s'entoure de 5H2O, de plus mon prof de chimie ma dit que l'ion cuivre capté 4H2O et l'ion sulfate 1H2O, se tromperait-il ?
Par quelle(s) liaison(s) l'ion Cu2+ capterait-il 5H2O (ou 4H2O) ? Ou peut-être que le cuivre en présence de 5H2O (ou 4H2O) perd deux électrons et se transforme en l'ion Cu2+, et selon maurice est un fait inexplicable donc je me contenterais de sa.
Juste un petit "briefing" , j'ai retenu et cru comprendre que :
L'ion sulfate se compose d'un atome de soufre et de 4 atomes d'oxygène. 2 atomes d'oxygène sur 4 on leur couche externe saturé donc pour atteindre une stabilité ils se piquent entre eux un électron et il y a donc toujours deux oxygène portant chacun une charge négative d'où SO42-. Ce sont donc des liaisons covalentes (passage d'un électrons ou 2 pour avoir leur couche externe saturé). Nous sommes ensuite en présence d'une liaison ionique entre Cu2+ et SO42-. Par contre pour les 5H2O

| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54816] |
|
| Posté le : 27/02/2008, 16:48 (Lu 53399 fois) |
Bonjour,
Après avoir repris la chimie, matière que je n'ai pas touchée depuis longtemps, et en faisant des recherches sur la cristalisation du sulfate de cuivre, je suis arrivé sur ce forum, dont j'ai lu les posts avec attention.
Je dois avouer que certaines choses m'échappent :
Après le post de maurice, je comprends bien que les charges [...]passent sans cesse d'un atome O à l'autre[...], mais, a l'instant t on peut représenter le ion sulfate de la manière suivante :
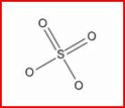 soit soit 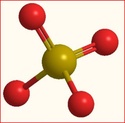
Il y a donc deux atome d'oxygène ayant encore un électron libre (soit 2 électrons pour le ion). Le ion sulfate peut donc s'assembler avec un ion cuivre (Cu2+) pour donner une molécule de sulfate de cuivre CuSO4.
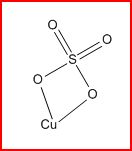 soit soit 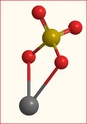
Mes question sont les suivantes :
1. Est-ce que mon post est correct ?
2. Pourquoi la molécule de sulfate de cuivre ne ressemble pas à ça :
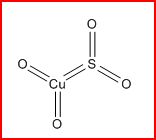
Certainement parce qu'ainsi aucun atome n'a pu compler ses couches, mais pourquoi mon logiciel (ChemDraw) s'obstine à me le représenter ainsi ?
3. Les deux doubles liaisons du ion sulfate peuvent elle être appelées covalences de coordination ?
4. CuSO4 + 5.H2O (sulfate de cuivre pentahydraté). Je me souviens que nous calculions le nombre de molécules d'eau (en l'occurence 5), mais ne me souviens plus comment. Etait-ce en le mettant en équation avec son acide (sufurique) ?
Merci de votre aide.
-baf
| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54893] |
|
| Posté le : 28/02/2008, 19:19 (Lu 53372 fois) |
Citation : wiki
Le cation Cu2+ (grosse boule bleue) est entouré par 4 molécules d'eau, la 5e molécule d'eau est plus loin. |
|
Pourquoi l'ion Cu2+ s'entoure de 5H2O, de plus mon prof de chimie ma dit que l'ion cuivre capté 4H2O et l'ion sulfate 1H2O, se tromperait-il ?
Par quelle(s) liaison(s) l'ion Cu2+ capterait-il 5H2O (ou 4H2O) ? Ou peut-être que le cuivre en présence de 5H2O (ou 4H2O) perd deux électrons et se transforme en l'ion Cu2+, et selon maurice est un fait inexplicable donc je me contenterais de sa.
Juste un petit "briefing" , j'ai retenu et cru comprendre que :
L'ion sulfate se compose d'un atome de soufre et de 4 atomes d'oxygène. 2 atomes d'oxygène sur 4 on leur couche externe saturé donc pour atteindre une stabilité ils se piquent entre eux un électron et il y a donc toujours deux oxygène portant chacun une charge négative d'où SO42-. Ce sont donc des liaisons covalentes (passage d'un électrons ou 2 pour avoir leur couche externe saturé). Nous sommes ensuite en présence d'une liaison ionique entre Cu2+ et SO42-. Par contre pour les 5H2O
Excuse moi de te passer devant bien que ton topic soit intéressant j'ai aussi besoin de réponse

----------
Edité le 28/02/2008, 19:20 par sil20
| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54907] |
|
| Posté le : 28/02/2008, 21:48 (Lu 53359 fois) |
je ne sais pas si ça a été dit, mais le sulfate de cuivre capte simplement 5 molécules d'eau dans sa maille cristalline une fois qu'il cristallise, point barre ...
| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54909] |
|
| Posté le : 28/02/2008, 22:05 (Lu 53352 fois) |
alexchimiste j'essaie de comprendre pourquoi tu dis cela (car je savais deja) mais en vain. Je demande juste si l'ion cuivre Cu2+ capte 5H20 ou alors 4H20 et l'ion sulfate 1H2O ce qui fait toujours au total 5H2O 
----------
Edité le 28/02/2008, 22:08 par sil20
| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54911] |
|
| Posté le : 28/02/2008, 22:55 (Lu 53344 fois) |
Cette structure SO42- me semble fausse. Le soufre a 6 liaisons et ça lui fait 12 électrons autour de lui, contrairement aux 8 qu'il lui faut, non?
|
Neradol |
|
|
| Re: Criastallisation du Sulfate de cuivre [54912] |
|
| Posté le : 28/02/2008, 23:07 (Lu 53340 fois) |
Non, le soufre peut avoir plus de 8 électrons autour de lui car il est hypervalent (les atomes à partir de la troisième ligne de la classif le sont)
| |
|
|
| Re: Criastallisation du Sulfate de cuivre [54913] |
|
| Posté le : 28/02/2008, 23:58 (Lu 53335 fois) |
Mais par exemple, on pourrait dessiner le SO2 avec 2 doubles liaisons avec l'oxygène, pourtant, il n'y a qu'une liaison double et une covalence dative, pour respecter la règle de l'octet
|
Neradol |
|
|
| Re: Criastallisation du Sulfate de cuivre [54938] |
|
| Posté le : 29/02/2008, 19:47 (Lu 53254 fois) |
Après avoir fait des recherches j'ai trouvé que seul l'ion cuivre est hydraté et donc il capte a lui seul les 5H2O est-ce bien sa ?
| |
|
|
| Re: Criastallisation du Sulfate de cuivre |
|
| Posté le : 03/03/2008, 20:23 (Lu 48684 fois) |
bon j'ai parlé a mon prof qui m'as dit que l'ion sulfate capté 1H2O et l'ion Cu2+ capté 4H2O :
[Cu(H2O)4]2+ et [SO4(H2O)]2-
Représentation de Lewis de l'ion sulfate :

Maintenant pourquoi l'ion sulfate capte-t-il 1H2O ? Je pense que 2 Hydrogène de la molécule polaire sont attiré par les 2 O- , est-ce sa ?
----------
Edité le 03/03/2008, 20:25 par sil20
----------
Edité le 03/03/2008, 20:27 par sil20
| |
|
|
Aztek Forum V4.00 Copyright (C) 2003 |