| schéma encre [76409] |
|
| Posté le : 02/04/2011, 22:30 (Lu 82683 fois) |
Bonsoir,
A l'issu de mon TPE sur l'encre ma camarade a collé sur le rapport final un schéma que je ne comprends pas du tout. ( elle non plus d'ailleurs, erreur de sa part). J'ai demandé a beaucoup de personnes mais personne n'arrive vraiment à répondre.
Je sais seulement que y a beaucoup de fonctions esters et des acides benzoiques.
Avez-vous des détails à ajouter svp?Comment appelle-on ce genre de schéma? est-ce une formule développée? ( dans notre programme on en est pas encore là)...
(étant donné qu'on ne peut pas poster des photos je l'ai mis sur ce site: http://aureliiiiieeeee.skyrock.com/ )
merci beaucoup
| |
|
|
| Re: schéma encre [76410] |
|
| Posté le : 02/04/2011, 23:18 (Lu 82672 fois) |
Pour héberger des photos gratuitement en bonne qualité il y a http://imageshack.us/ tu peux y déposer une photo sans même avoir un compte, mais si tu crées un compte tu pourras plus facilement les organiser.
Je dis ça parce que la photo que t'as mis sur skyblog a vraiment une très faible résolution et on ne voit pas grand chose, je ne peux rien lire, mais j'arrive tout de même à distinguer la molécule qui peut te poser problème.
Ces molécules sont écrites en formule topologique http://fr.wikipedia.org/wiki/Formule_topologique qui consiste en bref a ne pas représenter les atomes de carbone et d'hydrogène par leur symbole C et H, ça permet de gagner du temps de ne pas les écrire car il y en a partout en chimie organique.
Ta molécule est cyclique, elle est basée sur des cyclohexanes substitués et contient même plusieurs cycles.
Une autre notation est utilisée, qui est :

Il s'agit d'une représentation désuète du cycle benzénique qu'on doit normalement représenter par:

| |
|
|
| Re: schéma encre [76414] |
|
| Posté le : 02/04/2011, 23:29 (Lu 82659 fois) |
Je te déconseille de mettre ceci dans ton TPE ! Ces molécules sont si mal écrites qu'aucun chimiste ne pourrait les reconnaître ! 
Mettre des choses auxquelles vous ne comprenez rien, ce n'est pas la bonne solution pour avoir une bonne note...  Vous allez vous faire incendier par vos profs ! Vous allez vous faire incendier par vos profs !
| |
|
|
| Re: schéma encre [76415] |
|
| Posté le : 02/04/2011, 23:32 (Lu 82656 fois) |
Et puis faire des molécules dont une liaison mesure 15 cm par rapport aux autres qui en mesurent 0,5 cm c'est archi faux...
| |
|
|
| Re: schéma encre [76416] |
|
| Posté le : 02/04/2011, 23:39 (Lu 82653 fois) |
Archi faux ?
A bon car une molécule avec des traits pour représenter une liaison c'est juste peut-être ?
Non la longueur des liaisons on s'en moque royalement, pour des raisons d'encombrement tu es souvent obligé de dessiner des longs traits. Et toi comme moi sommes les premiers à le faire. Ce n'est qu'une représentation graphique, aucune longueur n'est représentative, même les logiciels de dessin moléculaire ne représentent pas les liaisons.
D'ailleurs, c'est comme dessiner une cétone ça n'as aucun sens vu qu'en réalité il y a des équilibres céto-énoliques, et que les molécules bougent dans tout les sens.
----------
Édité le 03/04/2011, 03:06 par Kevin
| |
|
|
| Re: schéma encre [76417] |
|
| Posté le : 02/04/2011, 23:40 (Lu 82649 fois) |
C'est pas faux  Mais en tous cas, on essaye de bien les dessiner, et de façon normalisée... Mais en tous cas, on essaye de bien les dessiner, et de façon normalisée...
| |
|
|
| Re: schéma encre [76419] |
|
| Posté le : 02/04/2011, 23:44 (Lu 82644 fois) |
C'est vrai que ce n'est pas très joli et par ailleurs je conseil à cette demoiselle de télécharger "Chemsketch" ou pluôt la suite ACDLAB (qui contient chemsketch).
C'est gratuit en version limitée, mais limitée ici c'est juste pour les nom automatiques des molécules et pour les recherche internet, autrement dit ce n'est ABSOLUMENT PAS limitatif ! Et c'est très simple à prendre en mains.
Par ailleurs c'est un logiciel qui permet de dessiner des montages et de voir les molécules en 3D en nuage (déjà un peu plus en accords avec la probabilité de présence des électrons).
| |
|
|
| Re: schéma encre [76422] |
|
| Posté le : 03/04/2011, 03:10 (Lu 82599 fois) |
Ouille erreur de débutant...
Dessiner une cétone ou un énol ça a du sens! Ce n'est pas la même chose!
Les cétones ne sont pas toujours en équilibre avec une forme énol! (Cela dépend de la cétone et du milieu).
Un équilibre céton-énol est un... équilibre! On peut donc isoler la cétone et l'énol si l'on souhaite, au contraire des formes de résonnances qui elles ne sont que des représentations limites de la même molécule!
|
Docteur en Chimie organique de Synthèse / Electrochimie organique |
|
|
| Re: schéma encre [76428] |
|
| Posté le : 03/04/2011, 11:33 (Lu 82541 fois) |
Ce que j'entends par là c'est que les molécules sont vivantes et qu'elle ne s'arrêtent pas à une seule position, et tu as très bien compris ce que je voulais dire. Après c'est sur l'une des formes que les réactions se font. Mais dessiner une molécule n'est déjà aucunement une représentation réelle de la molécule.
Après pour les règles, le dessin à la main ne les respectes pas les traits sont toujours déformées ? ET C'EST POUR CA que j'ai parler de logiciel informatique de dessin.
| |
|
|
| Re: schéma encre [76439] |
|
| Posté le : 03/04/2011, 15:01 (Lu 82472 fois) |
Non non et non... C'est faux! Toutes les molécules ne sont pas en équilibre avec une autre forme!
Encore une fois, tu peux très bien dessiner une cétone et avoir 100% de cétone en réalité e t0% d'énol.
Enfin le dessin d'une molécule n'est quand même pas si loin de la réalité ... C'est juste une version simplifiée... Sinon comment expliquer le fait que l'on puisse prédire la stéréochimie, les angles d'attaque et la réactivité par un simple petit dessin si ce dernier était totalement à coté de la plaque...
Alors oui, si tu le souhaites, tu peux te mettre à faire de la DFT ou à dessiner tes molécules sous forme de densité de probabilité électronique avec comme prétexte que tu souhaites représenter la réalité (et encore est ce vraiment la réalité?)...
Chacun ses priorités comme on dit!
|
Docteur en Chimie organique de Synthèse / Electrochimie organique |
|
|
| Re: schéma encre [76442] |
|
| Posté le : 03/04/2011, 16:13 (Lu 82464 fois) |
Mwouai pas très convaincu, ou alors tu bloques ton énol avec une base par exemple. Car dans toutes les réactions que l'on fait on regarde en premier la forme céto-énolique et on fait un choix de produit pour bloquer l'un ou l'autre. J'aimerai bien avoir un exemple de cétone libre (sans milieux spécial genre BF3, base, etc) qui ne forme qu'une cétone.
J'ai déjà vu des équilibres en faveur de l'un ou de l'autre mais jamais à 100% d'une des deux formes. Pour ça je demande vraiment à voir ! Car en 3 ans j'ai jamais eu un cours qui parlait de ça. J'aurai des notes de merde en orga je ne dit pas je fermerai ma gueuler sans raler, mais l'orga est bien la seule matière ou soit je major ou suis second depuis l'IUT. Donc en principe je connais plutôt bien mon cours (celà dit en dehors de mon cours je connais quelques trucs en plus mais pas tout non plus, c'est pour ça que je veux un exemple).
Donc ne pas prendre mes propos comme offense là mais juste comme une question.
----------
Édité le 03/04/2011, 16:18 par nobelios
| |
|
|
| Re: schéma encre |
|
| Posté le : 03/04/2011, 16:59 (Lu 82452 fois) |
Prend un spectre RMN de l'acétone ou une infra rouge... Tu vois une double liaison quelque part?
|
Docteur en Chimie organique de Synthèse / Electrochimie organique |
|
|
| Re: schéma encre [76446] |
|
| Posté le : 03/04/2011, 17:47 (Lu 82438 fois) |
La forme cétoniques est majoritaire mais celà ne veut ABSOLUMENT PAS dire que l'énol ne se forme pas. Et l'énol est à prendre en considération pour certaines réactions (après il est possible de forcer l'énol aussi).
"In an equilibrium between the two, acetone is more than 99.9% ketone, and less than 0.1% enol. Enolization is catalyzed by both acid and base"
Donc dessiner uniquement la forme cétonique n'est pas une représentation juste mais une représentation statistique. Donc il y a bien un équilibre aussi petit et insignifiant soit-il. C'est là que je veux en venir.
A présent je veux bien que tu me donne une molécule qui forme à 100% une cétone ou un énol mais à 100%. Car si c'est uniquement la forme énolique par exemple qui réagis dans une réaction et bien ton acétone c'est 0,1% qui réagissent pour former un composé x puis il se reforme 0,1% d'énol etc etc jusqu'à ce que tout ton énol soit consommé.
Et favoriser l'énol, accélèrera la vitesse de la réaction. 
Prend un RMN d'un acide organique, tu ne vois pas forcement les H du OH celà ne veux pas dire que tu n'as pas d'acide. En chimie on ne peut pas raisonner par l'absolu et rien n'est jamais représentatif à 100%. S'il y a bien un truc que j'ai compris en chimie c'est ça.
----------
Édité le 03/04/2011, 17:49 par nobelios
| |
|
|
| Re: schéma encre [76418] |
|
| Posté le : 02/04/2011, 23:42 (Lu 82645 fois) |
Oui enfin elles sont en terminales ^^ si on ne peut même pas utiliser une norme pour s'exprimer ou va t on? oui je merde la quantique, je sais très bien que ce qu'on écrit sur le papier est des milliards de fois plus grand que la réalité, mais il faut bien se représenter CORRECTEMENT les choses !
| |
|
|
| Re: schéma encre [76420] |
|
| Posté le : 02/04/2011, 23:47 (Lu 82641 fois) |
C'est du débat de sourd, tout comme OH- ou HO-. Cela n'aiderai pas cette personne et ne nous fera pas avancer plus vite. Autant se pencher sur comment présenter les molécules à l'aide d'un logiciel et sans passer par Skyblog pour ses devoirs. Ce site possède une connotation SMS, kikoolol, etc qui risque de discréditer ce qu'elle fait.
Pour répondre ce sont des formules semi développées planes (et encore ici on se passe même des hydrogènes que l'on devine). Le problème c'est que TRES RAPIDEMENT si on fait dans la formule développée plane, celà devient illisible et encombré.
----------
Édité le 02/04/2011, 23:49 par nobelios
| |
|
|
| Re: schéma encre [76423] |
|
| Posté le : 03/04/2011, 03:15 (Lu 82597 fois) |
Il y a des règles de dessin en chimie organique, règle que tous les chimistes organiciens suivent. Alors oui... Tu peux dessiner tes molécules n'importe comment et passer des heures à argumenter que tu préfères les dessiner comme ça... Mais est ce que cela veut vraiment la peine...
|
Docteur en Chimie organique de Synthèse / Electrochimie organique |
|
|
| Re: schéma encre [76424] |
|
| Posté le : 03/04/2011, 08:59 (Lu 82561 fois) |
Tu n'as pas compris ! Elle n'a mis sa page sur son blog que parce qu'elle ne sait pas comment on met des images ici. Rien à voir avec son TPE.
Comme dit Kevin, il y a des règles pour dessiner les molécules, une référence commune à tous les chimistes du monde.
Voir l'IUPAC :
Pure Appl.Chem., Vol.80, No.2, pp.277–410, 2008.
http://www.iupac.org/publications/pac/80/2/0277/
(téléchargeable en PDF)
| |
|
|
| Re: schéma encre [76427] |
|
| Posté le : 03/04/2011, 11:12 (Lu 82551 fois) |
Merci Clovis pour ce document que j'ai cherché hier soir sur le site de l'IUPAC mais je ne l'ai pas trouvé. On peut voir à la page 104 qu'en effet l'écriture du cycle benzénique avec l'anneau intérieur suggérant la délocalisation n'est pas désuète et l'IUPAC la considère encore comme acceptable.
| |
|
|
| Re: schéma encre [76425] |
|
| Posté le : 03/04/2011, 09:07 (Lu 82560 fois) |
C'est bien la spécialité de nobelios que de faire polémique la ou il n'y a vraiment pas matière à... il y a des règles pour dessiner les molécules, on ne dessine pas des liaisons de 15 cm la ou les mêmes sur le même schéma font 0,5 cm, quantique ou pas quantique. Si on commence à tout mélanger on ne s'en sortira jamais !
| |
|
|
| Re: schéma encre [76426] |
|
| Posté le : 03/04/2011, 10:35 (Lu 82556 fois) |
Bonjour, wow je suis démoralisée l'image est déjà mise sur mon T.P.E! Pourtant mon professeur de chimie m'a dit que le rapport est excellent.
Pour le schéma , sur le vrai je n'ai pas déssiné des liaisons de 15 cm avec d'autre de 0.5 cm j'ai bien mis toutes les mêmes mesures.
De plus ce schéma je l'ai extrait de : CHIMIE INDUSTRIELLE, 2eme édition, préface de Pierre Fillet, c'est un livre très sûr( pour des personnes à partir d'un bac +5). Donc je ne comprends pas pourquoi ces molécules sont si mal écrites 
Merci pour les logiciels proposés , je ne mettrai plus d'image sur skyblog, encore désolée.
Au fait je suis en Premiere S et on vient de commencer la chimie organique et on a commencé a voir les formules topologiques et ca ressemble pas à ça. Par exemple la résine modifiée à la colophane on n'a pas le droit de la représenter comme ceci sur une formule topologique?
Mais vous savez ce qu'est une resiné oléoglycéraphtaliques?
Je pense aussi que je vais me faire incendier par le jury d'autant plus que je suis dans un lycée très réputé.
Mais bon c'est trop tard, si on me demande ce que ce schéma représente:
Je dis: Ce schéma represente en fait les encres grasses. Les encres grasses contiennnent peu de solvants, mais sont chargées en résines et en huiles. Les liants des encres grasses sont des huiles plus précisément des résines phénoliques ( ou oléoglycérophtaliques mais je ne comprend pas ce mot) modifiées à la colophane. Donc en fait ce schéma représente une formule topologique ou bien semi-développé plane de cette molécule synthétisé. Elle est cyclique.... Je suis perdue.
Pourtant faut vraiment qu'ils soient stupide pour me poser cette question, c'est juste un schéma qui illustre mes propos!
Pour l'image en cliquant une fois sur la photo on la voit bien je pense.
Mais merci beaucoup pour les logiciels proposés je vais tout de suite les télécharger, ils doivent être très utiles.
----------
Édité le 03/04/2011, 10:40 par Aurelie
| |
|
|
| Re: schéma encre [76432] |
|
| Posté le : 03/04/2011, 12:00 (Lu 82525 fois) |
Mais non, ne t'en fait pas. Beaucoup ici sont en études de chimie, voir chimistes, chercheur etc et ont oublié que les lycéens ne sont pas des chimistes et pas des étudiants.
En chimie comme partout il y a des méthodes de rédaction, pour les noms, les dessins, les protocoles etc. Après c'est surtout pour que tout le monde s'accorde sur la compréhension. A présent que tout le monde se comprend, des gens se battes pour des conneries du genre si c'est plus beau en bleu ou en rouge et si on doit écrire dans un sens ou dans l'autre. C'est du pinaillage.
Je vais te dire une chose. Ma binôme de TP fait des rapports que je trouve moche, donc je préfère taper moi à la machine, mais ses contenus sont irréprochables. A côté de ça d'autres binômes font de joli rapports avec des tonnes de fautes.
Et bien je préfère franchement un papier moche avec des molécules asymétriques mais juste avec des données fiables qu'un chef d'œuvre visuel avec un texte qui sonne aussi faux qu'un sourire sur un publicité !
Bref, continu, perfectionne toi à ton rythme, écoutes les propositions que te font tes profs et croises les données que tu consultes pour avoir l'information la plus juste possible. Il n'y a pas de miracles, en chimie personne n'a la science infuse, c'est des information qui sont détenues par plusieurs personnes et il faut regarder un peu partout. Les chimistes qui s'imaginent êtres des dieux vivant et tout savoir sur tout sont dans le faux.
Un conseil pour les jury, il faut développer le maximum de points, de questions tordus à titre personnelles. Mais parler du stricte minimum. Et faire ceci avec la certitude que chaque chose que tu dis, tu la connais, car si tu parles de tout ce que tu sais déjà les question que l'on te posera tu ne saura pas y répondre !
Donc tu donnes des informations concises et précises et tu garde tout le reste pour les questions afin de ne pas te faire coincer. C'est ce qu'on a fait avec ma binôme pour la présentation de notre publi (enfin pseudo publi) et les quelques remarques de nos prof étaient précédé d'un seul propos. Votre travail est propre et maitrisé, ce que l'on va vous dire à présent c'est uniquement du bonus pour vous amélioré n'en tenez pas compte comme point négatif mais comme des avis personnels.
Et franchement pour l'oral on a juste fait au plus court et au plus démonstratif !
A oui et aussi ne jamais se déstabilisé face à un jury, il flaire ça, parler de façon vivante ne pas hésiter à bouger les mains (pas se gratter la jambe et tripoter son stylo) pour avoir l'air décontracté. Parler d'une voix modulée et pas monotone (genre lire un texte comme un robot). Il faut capter le publique sinon il n'écoute pas et cela discrédite ton travail même s'il est bon.
C'est ce que j'ai retenu de mes profs et des entretiens que j'ai passer pour mes stages, ça a fonctionné dans l'architecture en BEP, dans les travaux publics en BAC PRO, en chimie à l'IUT et à la FAC. Je sais pas si c'est universel, mais à chaque fois les conseils sont les mêmes et si on les applique ça se passe plutôt bien.
bonne chance pour la suite.
----------
Édité le 03/04/2011, 12:09 par nobelios
| |
|
|
| Re: schéma encre [76434] |
|
| Posté le : 03/04/2011, 12:14 (Lu 82517 fois) |
Citation : nobelios
Il n'y a pas de miracles, en chimie personne n'a la science infuse, c'est des information qui sont détenues par plusieurs personnes et il faut regarder un peu partout. Les chimistes qui s'imaginent êtres des dieux vivant et tout savoir sur tout sont dans le faux. |
|
T'es vraiment gonflé !!
| |
|
|
| résine oléoglycerophtalique [76433] |
|
| Posté le : 03/04/2011, 12:07 (Lu 82524 fois) |
Sans être expert de la chimie des peintures, je dirais que la résine oléoglycérophtalique est composée d'un ester d'un acide phtalique (peut être bien l'acide paraphtalique)

avec du glycérol
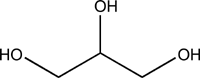
En classe de 1ere S ça m'étonnerait que tes profs te demandent grand chose de plus que d'identifier les fonctions chimiques dans cette molécule, la fonction ester ici et éventuellement de dire à partir de quel acide et alcool on obtient cet ester.
Le terme oléo me laisse penser que la molécule doit contenir des chaines carbonées linéaires longues (plus de 10 atomes de carbone), il se peut que ça soit un acide gras qui estérifie lui aussi des fonctions alcool du glycérol comme c'est le cas dans les glycérides http://fr.wikipedia.org/wiki/Acylglyc%C3%A9rol. Dans ce cas tu aurais un ester mixte du glycérol, certaines de ses fonctions alcool seraient estérifiées par un acide phtalique et d'autres par des acides gras, remarques aussi que l'acide phtalique contient 2 fonctions acides carboxyliques qui peuvent toutes les 2 estérifier 2 fonction alcool appartenant à 2 molécule de glycérol différentes, ainsi il peut se former des polymères qu'on appelle polyester.
----------
Édité le 03/04/2011, 12:10 par Geoffrey
| |
|
|
| Re: schéma encre [76443] |
|
| Posté le : 03/04/2011, 16:19 (Lu 82457 fois) |
Bonjour,
Pour revenir au sujet ^plus précisément les résine oléoglyccéropthaliques sont obtenues avec de l'anhydride phtalique, de la glycérine et un peu de colophane =Acide Abiétique.
Maintenant il faut considérer que le glycérol est 3 fois alcool, et qu'il peut réagir sur le diacide (ou l'anhydride) phtalique et l'acide abiétique qui est un monacide. Donc tout ça forme une résine avec la glycérine et l'acide phtalique pour faire la chaine polyester et quelques groupes abiétique fixés dessus.
En procédant en deux temps on peux sans doute obtenir un monoester abiétique puis créer la chaine polymère avec le diacide phtalique.
Les polymères obtenus avec les différents isomères phtaliques et un m^me glycol sont trés différents. Avec le para-phtalique on a le PET des bouteilles ou fibres, avec les autres isomères la chaine n'est pas aussi droite et on a des résines plus souples, des températures de fusion plus basses
|
Tri+traitement Produits chimiques 77 (Seine et Marne) |
|
|
| Re: schéma encre [76452] |
|
| Posté le : 03/04/2011, 20:02 (Lu 82408 fois) |
Je vous remercie à tous pour vos conseils et vos explications!
En fait pour résumer les résines oléoglycerophtaliques :
(Glycéryne + anhydryde phtalique) + une modification par des huiles donne des résines oléoglycérophtaliques?
Et pour le glycérol qui possède 3alcools c'est le 1,2,3-propanetriol ? mais le glycérol a lui seul contient des acides gras pourquoi ajoute-on d'autres molécules pour obtenir des encres grasses?
Et donc ici la fonction ester est créée à partir de l'acide .... et l'alcool: glycérol? Je ne trouve pas l'acide...
Je vous tiendrai au courant des questions qu'ils me poseront mercredi^^
En tout cas merci beaucoup!
| |
|
|
| Re: schéma encre [76462] |
|
| Posté le : 04/04/2011, 14:22 (Lu 78568 fois) |
Citation : Aurelie
Je vous remercie à tous pour vos conseils et vos explications!
En fait pour résumer les résines oléoglycerophtaliques :
(Glycéryne + anhydryde phtalique) + une modification par des huiles (NON par des acides GRAS = avec beaucoup de carbones) donne des résines oléoglycérophtaliques?
Et pour le glycérol qui possède 3alcools c'est le 1,2,3-propanetriol ? OUI
mais le glycérol a lui seul contient des acides gras (NON, iln'en contient pas) pourquoi ajoute-on d'autres molécules pour obtenir des encres grasses?
Et donc ici la fonction ester est créée à partir de l'acide PHTALIQUE ou ABIETIQUE .... et l'alcool: glycérol? Je ne trouve pas l'acide...
Je vous tiendrai au courant des questions qu'ils me poseront mercredi^^
En tout cas merci beaucoup!
|
|
Bonjour aurélie,
J'ai répondu en soulignant, j'espère que ça ira.
|
Tri+traitement Produits chimiques 77 (Seine et Marne) |
|
|
Aztek Forum V4.00 Copyright (C) 2003 |